Оглавление Введение Часть 1 Часть 2 Часть 3 Заключение
Глава 1 Глава 2 Глава 3 Глава 4 Глава 5 Глава 6 Глава 7 Литература
Глава 3
Гомеостаз органоидов и органелл
Одним из первых функционально значимых компартментов в иерархическом ряду участников гомеостатического мира были названы органоиды и органеллы растительных и животных клеток. Однако было бы не справедливым оставлять «за бортом» изложения микросомы, как прямых родителей первого гомеостатического барьера, - однослойной мембраны, реально выделивших в пространстве микрообъем для ожидаемого временем гомеостаза.
Микросомы
«Онтогенез» настоящего не уничтожил своего предка, как никогда не уничтожал этапных достижений эволюции. Он лишь несколько модифицировал его, адаптировав к функциональным специализациям исполняемых клетками и их органеллами задач. Хотя, по большому счёту, основное историческое предназначение микросом, как самого совершенного «хранителя» мобильных замкнутых пространств, способных не только хранить, но и исполнять важнейшие функциональные задачи в клетках благодаря своей «первичной мобильности», эксплуатируются повсеместно в своём нативном виде.
Это и пищеварительные вакуоли (вторичные лизосомы) у прокариот и эукариот, образующиеся в результате захвата пищи на одноклеточном уровне, обеспечивающие внутриклеточное пищеварение и экскрецию остатков пищи.
Это первичные лизосомы, обеспечивающие и захват, и гидролиз, и такую же экскрецию продуктов гидролиза биополимеров в своих строго изолированных, но подвижных объёмах внутри микрообъёмов клетки.
Это и аутолизосомы, и пероксисомы, обеспечивающие аутолиз клеточных фрагментов или окисление аминокислот соответственно, будь то амёба, лейкоцит, гепатоцит или растительная клетка.
Исторически сегодня микросома это некий функционально-транспортный компартмент, образующийся из фрагментов плазматической или ядерной мембраны, эндоплазматической сети или комплекса Гольджи (реже – из разрушаемых митохондрий) по пиноцитарному механизму.
Окружённые в связи с этим двойной мембраной, сегодняшние микросомы получают, транспортируют и «выбрасывают» своё содержимое обратным пиноцитозом в межклеточное пространство. Благодаря этому микросомы исполняют ещё одну более чем значимую роль: они обеспечивают постоянное обновление качественного состава всех мембранных образований клетки.
Наверное, есть все основания включить микросомы в общий перечень клеточных органоидов и органелл (таблицы 6 и 7), хотя их самостоятельность и уже тем более, - независимость, весьма условны.
Органеллы и органоиды растительных и животных клеток
Органеллы и органоиды[1] это внутриклеточные включения, «клеточные органы», обеспечивающие выполнение специфических функций в процессе жизнедеятельности клетки: хранение и передачу генетической информации, транспорт веществ, синтез и превращение веществ и энергии, деление, движение и прочее.
К органоидам эукариот относят ядро, клеточную и ядерную мембрану, митохондрии, комплекс Гольджи, эндоплазматическую сеть, лизосомы (таблица 6). К органеллам: хромосомы, ядрышко, рибосомы, микротрубочки, микрофиламенты (таблица 7). В животных клетках присутствуют также: центриоли, микрофибриллы, а в растительных – свойственные только им пластиды. Прокариоты лишены большинства органоидов[2], у них имеются лишь клеточная мембрана и рибосомы, отличающиеся от цитоплазматических рибосом клеток эукариот. В специализированных же клетках эукариот могут быть сложные структуры, в основе которых находятся универсальные органеллы, например, микротрубочки и центриоли – главные компоненты жгутиков и ресничек. Микрофибриллы лежат в основе тонофибрилл и нейрофибрилл.
Таблица 6. Клеточные органоиды (имеющие мембранное строение)
|
Наименование |
Животная клетка |
Растительная клетка |
|
Ядро |
Система генетической детерминации и регуляции белкового обмена |
Система генетической детерминации и регуляции белкового обмена |
|
Эндоплазмати-ческая сеть гранулярная (ЭПС) |
Синтез гормонов, ферментов, белков плазмы, мембран; сегрегация (обособление) синтезированных белков; образование мембран вакуолярной системы, плазмолеммы, синтез фосфолипидов |
Синтез гормонов, ферментов, белков плазмы, мембран; сегрегация (обособление) синтезированных белков; образование мембран вакуолярной системы, плазмолеммы, синтез фосфолипидов |
|
Эндоплазмати-ческая сеть гладкая (ЭПС) |
Метаболизм липидов и некоторых внутриклеточных полисахаридов |
Метаболизм липидов и некоторых внутриклеточных полисахаридов |
|
Пластинчатый комплекс Гольджи |
Секреция, сегрегация и накопление продуктов, синтезированных в ЭПС, синтез полисахаридов |
Секреция, сегрегация и накопление продуктов, синтезированных в ЭПС, синтез полисахаридов |
|
Лизосомы первичные |
Гидролиз биополимеров |
Гидролиз биополимеров |
|
Лизосомы вторичные (см. вакуоль) |
Результат фагоцитоза, пиноцитоза, трнсмембранный транспорт веществ |
Результат фагоцитоза, пиноцитоза, трнсмембранный транспорт веществ |
|
Аутолизосома |
Аутолиз клеточных компонентов |
Аутолиз клеточных компонентов |
|
Пероксисомы |
Окисление аминокислот, образование перекисей |
Окисление аминокислот, образование перекисей, защитная функция |
|
Митохондрии |
Синтез АТФ |
Синтез АТФ |
|
Кинетопласт |
Комплексная функция: движение и энергообеспечение движения |
Комплексная функция: движение и энергообеспечение движения |
|
Пластиды: хлоропласты хроматофоры лейкопласты хромопласты |
|
Фотосинтез, синтез и гидролиз вторичного крахмала (амилопласты); масла (элайопласты); белка (протеинопласты, протеопласты) |
|
Вакуоль |
Внутриклеточное пищеварение |
Накопления воды и питательных веществ |
Все специализированные структуры одноклеточных, многоклеточных растительных и животных клеток, построены по единому принципу и выполняют в них весьма сходные функции: от синтеза и деструкции белков, жиров, углеводов, органических и неорганических соединений, до исполнения механических и аналитических функций, включая процессы их энергетического обеспечения.
Таблица 7. Клеточные органеллы (имеющие немембранное строение)
|
Наименование |
Животная клетка |
Растительная клетка |
|
Ядрышко |
Место образования рибосомных РНК |
Место образования рибосомных РНК |
|
Центриоли (центросомы) |
Формирование веретена деления |
Формирование веретена деления |
|
Рибосомы |
Синтез белка |
Синтез белка |
|
Микротрубочки |
Цитоскелет, участие в транспорте веществ и органоидов |
Цитоскелет, участие в транспорте веществ и органоидов |
|
Микро-филаменты |
Сократимые элементы цитоскелета, подвижность клетки, внутриклеточное движение веществ |
Сократимые элементы цитоскелета, подвижность клетки, внутриклеточное движение веществ |
|
Микрофибриллы |
Сократительная функция клетки и внутриклеточного перемещения органоидов |
Сократительная функция клетки и внутриклеточного перемещения органоидов |
|
Жгутики |
Органы движения |
Органы движения |
|
Реснички |
Увеличение всасывающей поверхности |
Органы движения, защиты |
|
Диктиосомы, десмосомы |
Высоко контактные мембраны |
Орган межклеточного контакта |
Клетки растений поверх клеточной мембраны, как правило, покрыты твердой клеточной оболочкой[3], имеющей поры, через которые с помощью специальных выростов цитоплазмы, десмосом, соседние клетки связаны друг с другом[4]. У растительных клеток, прекративших свой рост, оболочки часто пропитываются лигнином, кремнеземом или другими веществами и становятся очень прочными, что определяет механические свойства самих растений. Клетки некоторых растительных тканей отличаются особенно прочными стенками, сохраняющими свои скелетные функции даже после гибели самих растений.
Растительные клетки имеют несколько или одну центральную вакуоль, занимающую обычно большую часть объема клетки и содержащую раствор различных солей, углеводов, органических кислот, алкалоидов, белков, а также запас воды. В цитоплазме растительных клеток имеются специальные органоиды – пластиды. Комплекс Гольджи в растительной клетке представлен рассеянными по цитоплазме диктиосомами.
Наверное, в плане избранной темы нашего изложения, нет большого смысла более подробно останавливаться на морфологических и функциональных специализациях органоидов и органелл. Эту информацию всегда и в более насыщенном объёме можно получить в рамках исследований цитологов и гистологов. Нас же, в большей мере, интересует неспецифическая (типическая) компонента гомеостатического устройства, составляющая суть обобщенных механизмов управления самоорганизованным «сложным» в общем балансе обмена веществом, энергией и информацией неравновесия.
Принимая во внимание то обстоятельство, что идентификационным требованиям избранного нами определения «гомеостаз» подлежат лишь представители «живой» материи, обладающие чётко выраженной границей раздела внешней и внутренней сред, позволим себе более подробно рассмотреть органоиды. Поскольку на этом уровне организации материи только они располагают собственно разделительной мембраной.
Механизмы адаптивной регуляции гомеостаза органоидов
При всем многообразии специализированных (специфических) задач и функций, исполняемых клеточными органоидами (см. Таблицы 6 и 7), рассмотрению которых посвящены все предметные исследования биологической химии, биологической физики, медицины и биологии, только один аспект остается, как правило, за пределами внимания обозревателей. Это та самая неспецифическая компонента «нормы реакции», которой мы посвятили эту книгу, и которая с точки зрения нормальной и патологической физиологии, может быть названа ключевой, опорной позицией «теории адаптации и гомеостатической регуляции адаптивных систем», их физиологическим и эволюционным смыслом.
Ведь по своей сути органоиды и отчасти органеллы, эти «продуценты жизни и смерти» белков, жиров, углеводов, энергии, обеспечивают исполнение самых разносторонних по своей специализации структурных и функциональных задач. Именно они составляют функциональную базу для исполнения прямых обязанностей самих клеток, тканей, органов, их систем и организма в целом.
Следует только обратить внимание на то, что органоиды и органеллы (в большей мере - органоиды) находятся в наиболее стабильных условиях внешней для них среды, пользуясь, в каком-то смысле, серьёзным «комфортным приоритетом». И действительно, внутреннее содержание клеток – цитоплазма является для них «внешней средой обитания». Это позволяет составить некий последовательный ряд средств «защиты» содержимого органоидов от непостоянства внешней среды:
1. внутренняя среда органоидов защищена мембраной и собственным гомеостазом;
2. внешняя для них среда защищена внутренней средой клеток, их гомеостазом;
3. сама клетка защищена клеточной мембраной;
4. внешняя для клеток среда защищена гомеостазом организма;
5. организм защищён покровными тканями;
6. высокосовершенный организм высших животных и человека защищён гомеостатическим поведением в относительно стабильном гомеостазе планетарной биосферы - среды их обитания;
7. планетарная биосфера защищена от космических вариаций магнитосферой, ионосферой, так называемым «озоновым экраном» и атмосферой Земли.
Даже, если на время отказаться от рассмотрения вопроса о первичности или вторичности «гомеостаза органоидов» в эволюционном аспекте, и вообще, забыть на время о том, являются ли органоиды самостоятельным объектом, наделенным собственным гомеостазом или это рудиментарная часть внешней среды, адаптированная и приспособленная морфологически к исполнению своих специализированных функций внутри клеток, нельзя не придать значения максимальной степени её защищенности от колебаний внешней среды[5], как нельзя отрицать наличие у органоидов собственной внутренней среды, отличной от внешнего им окружения.
Что же собственно так тщательно «защищает» гомеостаз или парагомеостаз органоидов? Почему именно она, их внутренняя среда, оказалась столь глубоко защищенной стабильностью такого количества демпферов температуры, ионов, химических реагентов?
На этот вопрос, с точки зрения эволюционной логики, мы старались найти ответ в предыдущем разделе. Постараемся ещё раз сформулировать его, но сформулировать несколько иначе: «Гомеостаз органоидов и органелл максимально защищен от несанкционированного действия биотических и абиотических факторов именно потому, что в их матриксе сконцентрированы самые чувствительные, самые «нежные» инструменты исполнения их гомеостатической роли в клетке (для высшего по отношению к ним иерарха). Это каталитические системы исполнения фактически всех ключевых химических реакций её жизнеобеспечения: энергетического, функционального и морфологического метаболизма.
Таким образом, статистическая вероятность последовательно, шаг за шагом была выведена историей эволюции на качественно новый уровень управления при использовании практически одного и того же набора инструментов в борьбе за оптимизацию их эффективности и рентабельности: она собрала в «нужных» местах набор «нужных» инструментов.
Вот почему эволюция именно так, а не иначе, расставила свои приоритеты при самоорганизации защиты своих инструментов прямого и опосредованного управляющего действия на уровень высшего своего достижения: биохимического катализа и каталитических систем. Оставаясь неизменно доступными для внешнего и внутреннего управления, они способны с максимально возможной для биологических систем чувствительностью, эффективностью и предельной для них оперативностью исполнять свою преобразующую миссию: окисление, восстановление, транскрипцию, транслокацию, аминирование, карбоксилирование, гидролиз и т.д., завершая всё синтезом, деструкцией или исполнением какой-либо внешней функции.
Поэтому, говоря о механизмах регуляции «гомеостаза» органоидов можно с уверенностью констатировать, что они более других чувствительны к малейшим изменениям условий субстратного, ионного и иного химического или физического регулирования, эффективностей и скоростей исполнения биохимических «норм реакций», а потому более всего защищены от возможных колебаний своего внешнего окружения (биотических и абиотических факторов).
Но эволюционный процесс гомеостатического усовершенствования «не мог остановиться» на этом, он был «обречён» энтальпией на дальнейшее развитие, создав условия наилучшего благоприятствования для функционирования своих инструментов:
1. наибольшей защищенностью от колебаний внешней среды, оптимизации биотических и абиотических условий исполнения химических взаимодействий;
2. сближения реагентов путём компартментализации реактивных зон,
3. увеличения эффективности и рентабельности химических превращений путём каталитического снижения энергий активации,
4. концентрации каталитических систем в миниатюрных объёмах органоидов,
5. строгого выбора реагентов путём их избирательного трансмембранного поступления,
6. формированием сложного белково-липидного композита биологических мембран (пятеричной структуры), позволяющего не только зафиксировать место расположения биологически активной молекулы белка (субстратного центра), сохранив её подвижность, но и существенно расширить диапазон чувствительности за счёт взаимодействия с конформационными возможностями двойного липидного окружения (гидрофобность, гидрофильность, Ван-дер-ваальсовы и другие электростатические межмолекулярные отношения) при постоянных флуктуациях электростатического сродства.
Именно этими действиями эволюционный процесс создал все предпосылки для естественного, физически оправданного усовершенствования биологического катализа:
1. через сложную, но идеальную для регулирования (изменения активностей), композицию вторичной (спираль), третичной (двойная спираль), четвертичной (глобула) и пятеричной (белково-липидный композит мембран) структуры (в организации материи);
2. через электростатическое сродство сложных пространственных конфигураций каталитических центров (стехиометрии) молекулярных структур биологических катализаторов (ферментов) к пространственной конфигурации молекул реагентов (матричного типа);
3. через электростатическое сродство молекул конечных продуктов после завершения каждого предыдущего этапа катализа к конфигурации каталитического центра следующего фермента в цепи последовательных химических превращений.
Уже сам характер таких достижений, подкрепленный устойчивостью внешней среды, локализацией мест исполнения реакций, а также структурными возможностями появившихся мембранных образований, позволил реализовать предопределённый путь усовершенствования биологического катализа формированием последовательных цепей ферментов в единый структурно-функциональный комплекс специализированных ферментных систем. При этом необходимость рационального и последовательного катализа была предопределена не только его очевидной целесообразностью и рациональностью, она была обустроена силами межмолекулярных взаимодействий электростатического свойства, заставивших шаг за шагом избирательно «выстроить» необходимые ферменты в «каталитический конвейер» требуемого биохимического процесса, фиксировав их мембранными или трансмембранными образованиями.
При этом гарантированная лабильность пространственных конфигураций (конформаций) биомолекул без потери ими основной структуры (первичной, вторичной и третичной), сделала их совершеннейшим инструментом гомеостатических систем.
Очень важно, что чувствительность этого инструмента (биохимического катализа) не только чрезвычайно высока и почти абсолютно избирательна для процессов внутреннего регулирования (субстратного, ионного), обеспечивающих оптимизацию скорости исполнения химических превращений, она доступна для внешних влияний релятивистского, гравитационного и иного волнового и электростатического свойства[6].
Очень интересен механизм такой чувствительности, демонстрирующий уникальное его совершенство на непосредственном стыке живой и неживой природы в едином гомеостатическом мире. Наиболее яркий и известный тому пример: фотосинтез зелёных растений, демонстрирующий способность акцептовать элементарные релятивистские потоки фотонов, преобразуя их энергию в энергию химических связей.
Фотосинтез[7]
Фотосинтез – это, прежде всего, преобразование энергии света в химическую энергию связей. Фотосинтез происходит в тилакоидах хлоро- или хромопластов и накапливается в форме АТР и водорода, связанного с коферментом. Фотосинтез зелёных растений протекает в хлоропластах в две стадии:
1. так называемые «световые реакции», идущие только тогда, когда на растение падает свет и
2. «темновые реакции», которые могут происходить как в темноте, так и на свету.
В световых реакциях энергия света поглощается хлорофиллом и другими пигментами фотосинтезирующих клеток и запасается в виде двух высокоэнергетических продуктов ATP и NADPH. Одновременно выделяется кислород.
В темновых реакциях образовавшиеся в световой фазе ATP, NADPH используются для восстановления двуокиси углерода до глюкозы и других органических продуктов.
Набор светособирающих пигментов с его реакционным центром, поставляющим высокоэнергетические электроны для восстановления, образует фотосистему I, максимально возбуждаемую светом с длиной волны £ 700 нм (красное падение) и фотосистему II (ФС-1 и ФС-2). Каждая фотосистема содержит:
1. одну молекулу «пигмента реакционного центра» хлорофилла а, которая после поглощения фотона света (возбуждения) выполняет фотохимическую работу, связанную с переносом «выбитых» фотоном электронов;
2. множество молекул хлорофиллов аi и bi, каратиноидов, пластохинонов, цитохромов и ряда других веществ, составляющих электрон-транспортную цепь (см. таблица).
ФС-1 в качестве реактивного центра имеет пигмент 700 (Р-700 хлорофилла а1), а ФС-2 представлена пигментом 680 (Р-680 хлорофилла а2) и молекулами хлорофилла bi.
Таблица 8. Приблизительный состав «усреднённой» фотосинтезирующей единицы хлоропластов (на примере шпината) по Р. Грегори[8]
|
Наименование компонента |
Число молекул |
Молекуляр-ная масса |
lmax (нм) |
|
Хлорофилл а |
160 |
893,5 |
662-410 |
|
Хлорофилл b |
70 |
907,5 |
644-430 |
|
Каратиноиды |
48 |
|
|
|
Пластохинон А |
16 |
817,3 |
290 |
|
Пластохинон В |
8 |
749,2 |
261 |
|
Пластохинон С |
4 |
|
255 |
|
a-токоферол |
10 |
430,7 |
292 |
|
a-токоферилхолин |
4 |
|
284 |
|
Витамин К2 |
4 |
580,9-649,0 |
243-328 |
|
Фосфолипиды |
116 |
|
|
|
Сульфолипиды |
48 |
|
|
|
Галактозилглицериды |
490 |
|
|
|
Железо |
12 атомов |
|
|
|
Ферредоксин |
5 |
|
|
|
Цитохром b563 |
1 |
|
|
|
Цитохром b559 |
|
|
|
|
Цитохром f |
1 |
|
|
|
Медь |
6 атомов |
|
|
|
Пластоцианин |
1 |
|
|
|
Марганец |
2 атома |
|
|
|
Белок |
928000 д |
|
|
На рисунке 14 приведена схема, позволяющая проследить путь потока электронов между фотосистемами ФС-1 и ФС-2, а также электрохимические взаимоотношения этих двух систем в световых реакциях.
Именно здесь осуществляется уникальный процесс акцепта и преобразования сверхвысоких частот релятивистского потока в более низкие, соизмеримые с реактивными возможностями химических преобразований. Попытаемся проследить этот путь.
В момент поглощения квантов света фотосистемой I время контакта фотона с реактивной зоной пигментов составляет:
~10-12-10-13с.
В момент соударения обогащённый энергией фотонов, электрон молекулы пигмента «выбивается» из реактивного центра на более высокий энергетический уровень, теряя при этом один спин (1/2) на прежнем и приобретая дополнительный спин на новом уровне. При этом, время его «возбуждённой жизни» составляет приблизительно:
~10-8-10-9с,
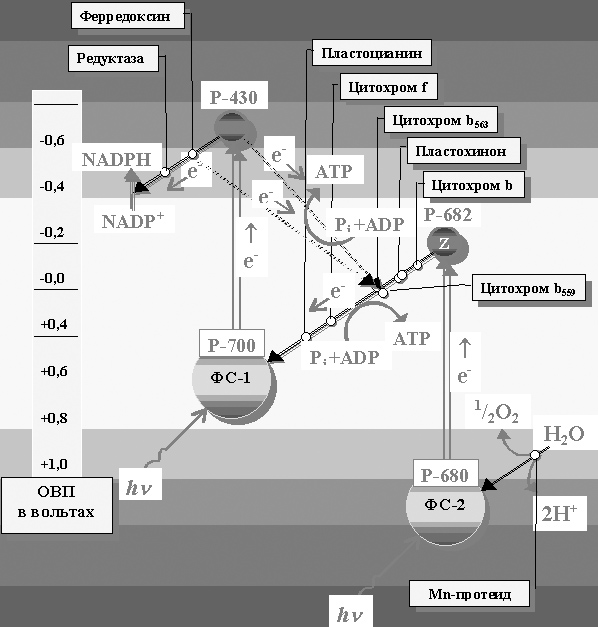
Рисунок 14. Принципиальная схема взаимодействия фотосистем I и II в хлорофилле высших растений.
(Z- гаситель неизвестной химической природы; ОВП – окислительно-восстановительный потенциал соответствующих центров)
Т.о. возбуждаемая система приобретает возможность увеличить начальное время возбуждения или «импульс возбуждения» в 2 раза (на четыре порядка). Это позволяет последовательно передавать электронное возбуждение по цепи переносчиков на молекулу NADP-гидрогеназы и АТР-синтетазы, восстанавливая NADP+ до NADPН и ADP до ATP.
Это происходит за счёт получения электроном энергии одного дополнительного оборота спина () на новом энергетическом уровне. Таким образом, результирующий спин энергетического уровня S становится равным «единице» (синглетное состояние):
S = 1/2+1/2 = 1
2S, соответственно, приобретает значение «два» (дублетное состояние) ():
2S = 2(1/2+1/2) = 2
а спиновая мультиплетность возбуждённого состояния молекулы (2S+1), становится равной «трем» (триплетное состояние) (++):
2S + S1 = 2 + 1 = 3
Таким образом, система существенно «теряет» энергию светового потока (фотона), но зато выигрывает тем, что получает удивительную способность адаптировать время возбуждения к времени активации химического процесса:
~10-2-10-4с
что действительно соизмеримо со скоростями биохимических реакций и именно такие электроны имеют наибольшую вероятность дезактивироваться путём передачи энергии на химический процесс (рисунок 15). Т.е. триплетный уровень ниже энергетически, а химическая активность пигментов в этом состоянии много выше.
Именно в этих, кратном двум[9] преобразованиях, результирующих суммарный квантовый эффект[10], скрыт ключевой механизм трансформации волновой энергии в колебательную, колебательной в химическую энергию возбуждения, а энергии возбуждения в энергию связи, преобразующей само вещество.
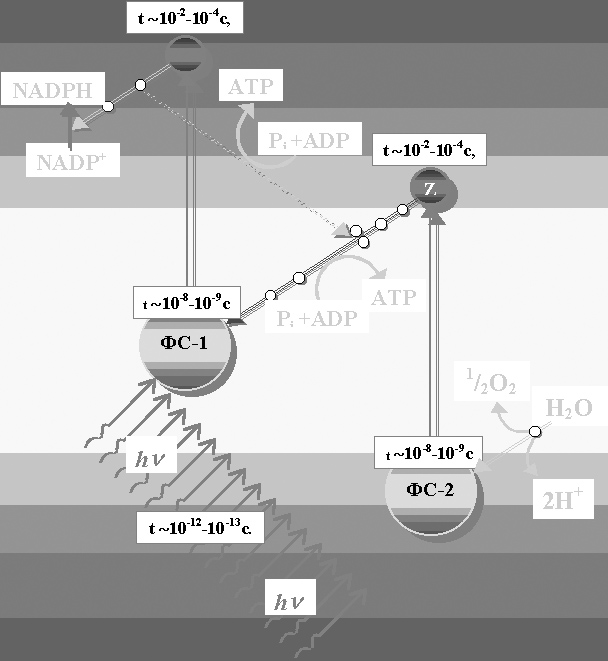
Рисунок 15. Принципиальная схема трансформации релятивистских частот и энергий
при фотосинтезе (частотный гаситель)
В результате такого действия в фотосистеме I (ФС-1) возникает так называемая «электронная дырка»[11] или локальное уменьшение электронной плотности. Эта «дырка» моментально заполняется электроном (электронной плотностью) фотосистемы II (ФС-2). Образовавшаяся «дырка» (условно - электронный дефицит[12]) в ФС-1 заполняется по цепи переносчиков электронов, связывающей ФС-1 и ФС-2.
Это приводит к возникновению новой «дырки», но уже в ФС-2. Новая «дырка» также последовательно заполняется электронной плотностью электрона, поступающего из диссоциирующей Н2О, вызывая таким образом, смещение баланса её диссоциации. Необходимость исполнения баланса нормы реакции диссоциации приводит к реальному окислению Н2О до протонов и кислорода:
2Н2О ®4Н++О2
Кислород поступает во внешнюю среду а протоны используются при восстановлении NADP+ и синтезе ATP. Таким образом, вода, окисляясь (мнимо окисляясь[13]) обеспечивает фотосинтетический процесс:
1. электронами, заполняющими «дырки» в ФС-2;
2. Н+ ионы (протоны), поступающие в среду и необходимые для восстановления NADP+ до NADPH и осуществления протонного фосфорилирования молекулы ADP до ATP;
3. молекулярный кислород О2, выделяемый в газовую среду наземными растениями и в водную – водорослями.
Если обобщить представленную последовательность событий световой части фотосинтеза (рисунок 16), то её можно представить в виде уравнения:
2Н2О + 2NADP+ ® О2+ 2NADPH + 2Н+
где на каждый электрон, переходящий от Н2О к NADP+, поглощается 2 кванта света (по одному на каждую фотосистему), а для образования одной молекулы О2 от Н2О должны быть переданы 4 (четыре) электрона и поглощено 8 (восемь) фотонов: 4 (четыре) на ФС-1 и 4 (четыре) на ФС-2.
В темновых реакциях фотосинтеза при использовании продуктов светового процесса (ATP и Н+) из СО2 синтезируется углеводород:
6СО2+12Н2+АТР = С6Н12О6+6Н2О
Суммарная же реакция темновых процессов фотосинтеза в цикле Кальвина записывается как:
6СО2+18АТР+12Н2О+12NADPH+12Н+ = С6Н12О6+18Рi+18ADP+12NADP+
При этом, общая реакция фотосинтеза может быть представлена в более простом виде:
6СО2+12Н2О = С6Н12О6+6Н2О +6О2
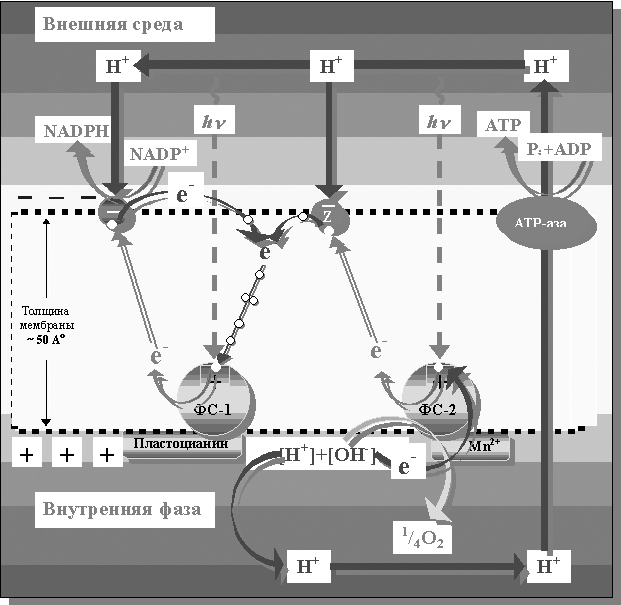
Рисунок 16. Принципиальная схема исполнения световых реакций фотосинтеза
Светорецепция зрения[14]
Другой пример, демонстрирующий предельное совершенство взаимодействия релятивистского и нерелятивистского на непосредственном стыке живой и неживой природы, это светорецепция в органах зрения.
Однако, если фотосинтез зелёных растений демонстрирует способность акцептовать элементарные релятивистские потоки фотонов, преобразуя их энергию в энергию химических связей, то светорецепция глаза позволяет проследить иной эффект действия: способность акцептовать элементарные релятивистские потоки фотонов, преобразуя их энергию в энергию и образ электрического сигнала. При этом, если в процессе фотосинтеза мы могли наблюдать частотные трансформации релятивистского от ~10-12-10-13с до ~10-2-10-4с, то светорецепция демонстрирует возможность более глубоких частотных преобразований, вплоть до уровня ~1-10-1с, сохраняя для анализа (ЦНС) широкий спектр и образ цветовой (длины волн от 380 до 760 нм) и световой (яркость[15]) гаммы наблюдаемой динамической картины событий.
Свет, попавший в глаз, фокусируется при помощи хрусталика на слой светочувствительных клеток[16] сетчатки глаза: палочках и колбочках (~108). Палочки располагаются по всей поверхности полусферической сетчатки и отвечают за чёрно-белое или сумеречное зрение, их примерно 125 млн. Они способны реагировать всего на 5 квантов света Колбочек ~ 6,5 млн и они отвечают при достаточно ядро освещении за восприятие цвета.
Строение сетчатки человека и высших животных может показаться парадоксальным, т.к. светочувствительные клетки находятся в заднем слое сетчатки. Прежде, чем свет попадает на них, он должен пройти через несколько слоёв нервных клеток. Мало того, сами клетки ориентированы к свету своим внутренним сегментом, не содержащим зрительного пигмента. Однако такая организация не снижает существенно чувствительности глаза к свету, т.к. нервные клетки и внутренние сегменты светочувствительных клеток прозрачны для видимого света. Тем не менее, около 4% света отражается от роговицы, а около 50% поглощается оптическими средами глаза. Таким образом, 60-65% света, дошедшего до сетчатки, проходит сквозь неё и поглощается в клетках пигментного эпителия.
Зрительный пигмент: родопсин, – сложный белок, состоящий из опсина и хромофильной группы – ретинальдегида или просто ретиналя. Хромофором родопсина является 11-цис-ретиналь, одной из изоформ ретиналя.
Известны и другие, родственные родопсину зрительные пигменты. Так опсины колбочек в комплексе с 11-цис-ретиналем называют порфиропсинами и т.д. Наиболее значимые из них приведены в таблице 9.
Таблица 9. Положение основных максимумов поглощения ретиналей и зрительных пигментов
|
Свободный альдегид |
Зрительный пигмент |
||
|
Ретиналь |
387 нм |
Родопсин |
500 нм |
|
(полностью транс) |
25800 см-1 |
|
20000 см-1 |
|
Ретиналь |
376 нм |
Порфиропсин |
522 нм |
|
(11-цис) |
26600 см-1 |
(колбочки) |
19200 см-1 |
|
3-дегидроретиналь |
393 нм |
Иодопсин |
562 нм |
|
(11-цис) |
25400 см-1 |
|
17800 см-1 |
В фоторецепторах ретиналь (ретиналь1 и ретиналь2) являют собой трансформированную форму ретинола или витамина А (ретинол1-витамин А1 С19Н27СН2ОН; ретинол2-витамин А2 С19Н52СН2ОН) посредством алкогольдегидрогеназы и связаны с фосфолипидами и белками. Поэтому ретинали – это альдегиды.
В ретиналях конечная группа молекулы не =СН-СН2ОН, а =СН-СН=О и брутто-формулы ретиналя1 С19Н27СНО и ретиналя2 С19Н52СНО соответственно, а число p–связей в ретиналях на одну больше, чем в ретинолах.
Ретинали служат хромотофорными группами зрительных пигментов, содержащих липопротеины, - опсинами. Опсины колбочек и палочек разнятся. Соответственно, возникают 4 основных вида зрительного пигмента, охарактеризованных в таблице.
Таблица 10. Основные характеристики зрительных пигментов при фоторецепции.
|
Процесс |
Максимум поглощения, нм |
|
ДФН+ опсин палочек ↔ родопсин
ДФН×Н опсин палочек ↔ йодопсин Алкогольдегидрогеназа |
500
562 |
|
ДФН+ опсин палочек ↔ порфиропсин
ДФН×Н опсин палочек ↔ цианопсин Алкогольдегидрогеназа |
522
620 |
Вслед за поглощением света в фоторецепторе возникает некая фотохимическая реакция, связанная с цис-транс-изомеризацией композита ретиналь-опсин (вокруг двойных связей)[17].
При возбуждении молекулы светом происходит перестройка p–электронной плотности и барьер внутреннего вращения снижается. Время жизни молекулы в таком синглетном возбуждённом состоянии составляет ~10-9с, время же, необходимое для поворота ~10-11-10-12с.
Поскольку квантовый выход для реакции изомеризации равен 0,5-0,7 при энергии кванта света с l=500 нм составляющей 210 кДж×моль-1, её более чем достаточно для исполнения цис-транс-перехода, т.е. процесса изомеризации (=105 кДж×моль-1).
Таким образом, фоторецепция сводится к возбуждению и изомеризации хромофора (цис-транс-переходу), сопровождающейся последовательным изменением стехиометрического сродства с активным центром опсина. При этом, происходит последовательное уменьшение частотных характеристик промежуточных состояний цистрансродопсина вплодь до ретиналя (рисунок 17).
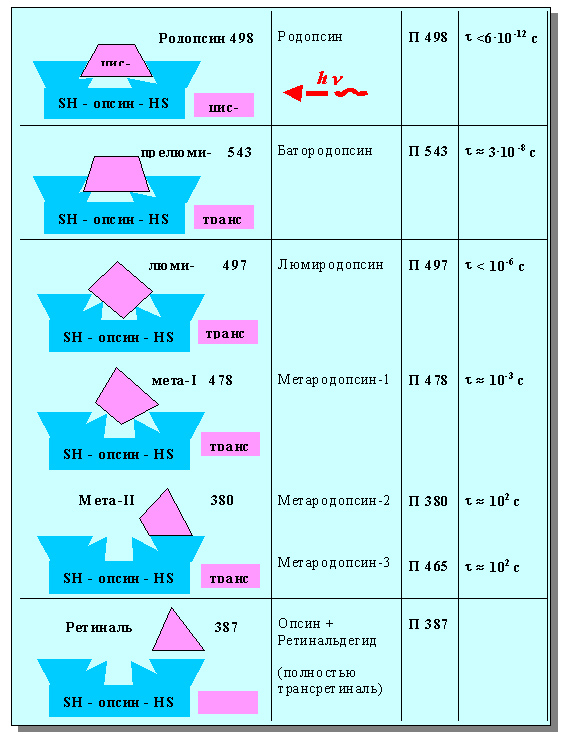
Рисунок 17. Инициированные светом конформационные превращения родопсина.
Следующая фаза преобразований, возникающая в ответ на возбуждение и конформирование родопсина, составляет суть механизма сопряжения молекулярного возбуждения с возбуждением мембран вследствие изменения их ионной проницаемости и, соответственно, модификацией трансмембранных электрических потенциалов.
Также как в случае с хлоропластами, мембраны зрительных клеток имеют знак плюс на внутренней стороне мембраны, а отрицательный заряд снаружи[18]. Плазматическая мембрана внешнего сегмента палочек (место локализации хроматофора) содержит большое количество Na+-селективных каналов. В темноте они открыты и, в связи с этим, внутрь клетки направлен постоянный ток ионизированного Na+, а К+ - наружу за счёт неэффективной работы К+-Na+АТР-азы.
Вследствие световой стимуляции и конформирования молекулы родопсина, предположительно исполняющего обязанности структурной части Na+-каналов[19], каналы закрываются, Na+-ток замедляется, усиливая уровень поляризации мембран от –30 до –70 мВ. При уровне поляризации мембран –30-40 мВ происходит активация работы Na+-Са++-АТРазы[20], уменьшающей содержание внутриклеточного Са++. А это означает, что уменьшается и активность трансмембранной аденилатциклазы[21], а значит и цАМР. Отношение цАМР/цGМР изменяется в пользу доминирования цGМР19, что приводит в отсутствии света (или низкой его эффективности) к открытию (или неполному открытию[22]) Na+-каналов[23].
Внешний сегмент палочек содержит 103 дисков, в каждом из которых находится 106 молекул родопсина. Поэтому поглощение одного фотона света способно изменить поток ионов на 1-2%, т.е. один фотон управляет 106-107 ионами20.
В свою очередь, конформированный (или как принято говорить - «обесцвеченный») под действием света родопсин, сам способен активизировать целый каскад ферментативных процессов, в котором важную роль играет трансдуцин. При взаимодействии с активированным родопсином этот белок распадается на субъединицы. Поскольку каждая молекула родопсина включает 102 молекул трансдуцина, которые, в свою очередь, активируют 103 молекул фосфодиестеразы, то это приводит к весьма активному гидролизу цGMP. Эффект закрытия каналов таким образом происходит за 10-3с, а изменение фронта электрического сигнала (при мгновенной вспышке) – за 4×10-3с (т.е. почти также, как и в фазу деполяризации мембран кардиомиоцитов при формировании потенциала действия). Иными словами: длительность сигнала полностью зависит от интенсивности и времени освещённости сетчатки глаза. Поэтому так называемое «остаточная картинка» или время реполяризации полностью зависит от скорости восстановления ионного баланса после прекращения светового потока на сетчатку и исчисляется ~1-101с.
Если принять во внимание, что степень поляризации мембран зрительных клеток не очень отличается при реакции на один или нескольких фотонов, т.е. мало зависит от освещённости (что представляется вполне естественным при столь высоких скоростях реактивной деполяризации), то возникает естественный вопрос: каким же образом мы в состоянии наблюдать столь яркую и разнообразную картину мира, не используя в качестве информации электрические сигналы импульсного типа? Ведь ориентация только на амплитуду полученного сигнала (n×101мВ) не может даже теоретически предоставить аналитический инструмент ЦНС для организации хоть сколько-нибудь острого видения. Для этого нужны соответствующие частоты и их разница. Поэтому очень интересен и важен для понимания принципа синтеза и «обзора картинки» происходящего, электрофизиологический механизм трансформации разницы амплитуд электрических сигналов в частоту нормированного электрического сигнала зрительных нейронов.
И хотя этот вопрос менее других изучен и носит больше гипотетический характер, ответ на него представляется не очень сложным, ибо складывается из структурно-функциональных особенностей иннервации глаза, где каждый отдельный нейрон иннервирует несколько зрительных клеток[24]. Благодаря этому, акцептуемая разность постоянно меняющихся потенциалов палочек и колбочек, позволяет нейронам формировать собственные потенциалы действия равновеликой амплитуды и разных частот, индуцированных разностью этих потенциалов, не превышающих возможностей рефрактерного периода.
Таким способом, акцепт зрительной информации, реализующий себя в способности возбуждения молекулярных орбиталей и ответного step by step конформирования структур ретинола, ретиналь-опсин композита, белково-липидного композита мембран светочувствительных клеток и зрительных нейронов. Это позволяет сформировать пакет электрических импульсов адекватной продолжительности и информационно насыщенной частоты. Где информация закодирована частотой импульсов (рисунок 18), а адекватность обеспечена их длительностью, соизмеримой со скоростью и нормами реакций других метаболических процессов.

Рисунок 18. Электрические явления в сетчатке и зрительном нерве
Фототаксис и фототропизм
Фототаксис - это способность направленного движения или направленной ориентации (фототропизм) объекта к источнику света (положительный эффект) или от него (отрицательный эффект) обычно относят к простейшим видам фоторецепции. Однако у высших растений хлоропласты ориентированы таким образом, что поглощается максимальное количество света, а некоторые организмы, напротив, избегают освещенных мест.
Суточные (чередование светового дня и тёмной ночи) и даже внутригодовые (длительность светового дня) циклы также являются характерными, наверное, для всех живых организмов. Поэтому правильнее было бы назвать эффект фототаксиса и фототропизма древнейшими видами физиологического ответа на действие солнечного света, т.е. способность трансформировать энергию фотонов в механическую энергию движения.
Как пример такой, реально «простейшей» способности, - поведение «эвглены зелёной» - простейшего одноклеточного жгутикового организма. Обладая оранжево-красным фоторецепторным пятном – стигмой, возникшей, скорее всего, из собственно жгутика и реснички[25] и ассоциировавшей фоточувствительный пигмент, стигма, под действием света и схожих молекулярных трансформаций, создаёт своего рода «нервный» импульс в жгутике. При этом молекулярная структура жгутика схоже конформирует и в результате эвглена движется по направлению к свету.
Как указывает профессор М.В. Волькинштейн, ссылаясь на доктора Уолкена22, детально изучавшего фототаксис «эвглены зелёной»: «система стигма-жгутик может рассматриваться как сервомеханизм[26] с обратной связью, обеспечивающий максимальную освещённость организма» путём его физической ориентации к свету.
Вот ещё один частный пример оптимизации условий комплексного физического и физико-химического регулирования оптимума исполнения нормы реакции.
Ионное фосфорилирование
Эволюция была столь мудра и так рациональна, что не могла в процессе усложнения материи не использовать энергию пассивного движения ионов (диффузии) в общем балансе обмена веществом, энергией и информацией. В особенности это касается трансмембранного движения таких ионов, как: Н+, К+, Na+, Ca2+.
До появления биологических мембран это было также не мыслимо, как не возможен эффект фотохимических преобразований в отсутствии света. Но, если фотосинтез и фоторецепция создали уникальные прецеденты поглощения энергии фотонов и её преобразования в энергию химической связи или электрический сигнал, то движение ионов в электростатическом поле мембраны, если оно совершается по градиенту концентраций, всегда сопряжено с собственно производством свободной энергии или, говоря языком профессора И.Р. Пригожина: «производством энтропии».
При этом важно различать возможность движения ионов через мембрану:
1. в заряженном состоянии (канальные токи К+; Na+; Са++) и
2. в связанном состоянии (К+-Na+; Na+-Са++- ионообменный транспорт, облегченная диффузия)[27], когда заряд иона практически нейтрализован зарядом ионного центра молекулы белка-переносчика.
Какова же эта энергия, о которой мы говорим?
Известно, что напряжённость электростатического поля (Е) биологических мембран относительно высока и составляет ~104-105В×см-1 ([28]). Она может быть описана формулой:
Е = -lim DU×DL-1 = -dU×dL-1
где: DU разность потенциалов;
DL расстояние по силовой линии между эквипотнциаль-ными поверхностями мембраны, за которую можно условно принять билипидную мембрану[29];
dU×dL-1 градиент потенциала.
Для определения количества энергии (DG), выделяемой при движении ионов (в виде заряженных частиц) по концентрационному градиенту через такое высоко напряжённое электростатическое поле, можно использовать формулу, описывающую энергию переноса заряженной частицы в однородном электрическом поле:
DG = q×E×L
где: q величина заряда;
E напряжённость электростатического поля;
L протяжённость электростатического поля, которое пересекает заряженная частица (толщина мембраны).
При расчётах, связанных с активным трансмембранным транспортом ионов, находящихся в это время в незаряженном состоянии, энергию переноса массы иона против концентрационного градиента следует производить по формуле:
DG = RT×(a2/a1) = RT×(c2/c1)
где: DG изменение свободной энергии системы;
a активность иона;
c его концентрация;
1 меньшая концентрация;
2 большая концентрация.
Пример 1: Расчёт энергобаланса работы К-Na-АТРазы. Достоверно установлено, что активный транспорт ионов К+ и Na+ обеспечивается энергией гидролиза АТР. Причем, гидролиз 1 молекулы АТР сопровождается транспортом 3 ионов Na+ и 2 ионов К+ ([30]) при условии наличия постоянных диффузных токов в клетку и из клетки. В связи с этим, энергобаланс К-Na-обмена складывается из двух статей:
1. Энергетические затраты:
расходование энергии при активном транспортировании этих ионов К-Na-АТРазой против градиента их концентраций:
входящий ток калия 8,43 кДж×моль-1,
выходящий ток натрия 5,98 кДж×моль-1,
что совпадает с результатами расчётов Э.Лайтфута[31]. Т.к. стехиометрия К-Na-АТРазы составляет 2К:3Na, легко рассчитать, что транспорт:
1 иона К+ 08,43 кДж
2 ионов К+ 16,86 кДж
4 ионов К+ 33,72 кДж
1 иона Na+ 05,98 кДж
3 ионов Na+ 17,94 кДж
6 ионов Na+ 35,88 кДж
итого: 69,60 кДж
т.к. энергия гидролиза 1 молекулы АТР освобождает 32,23 кДж энергии, то на 2 цикла работы (2 оборота) АТРазы будет израсходовано 2 моля АТР (2,159 М)
2. Поставка энергии тепла при диффузном движении этих же ионов через электростатическое поле мембраны по градиенту их концентраций:
выходящий ток калия
1 ион К+ 16,6 кДж
2 иона К+ 33,2 кДж
4 иона К+ 66,4 кДж
1 ион Na+ 4,9 кДж
3 иона Na+ 14,7 кДж
6 ионов Na+ 29,4 кДж
итого: баланс положительный 95,8 кДж
Этой энергии достаточно, чтобы нагреть литр воды на 22,9°С или фосфорилировать 2,97 молей АDР до АТР при эффективности 67,34% и прямых теплопотерях 32,66%
Пример 2: Расчёт энергетических возможностей К+-Nа+ обмена при изменении уровня поляризации мембран (К+ градиента). Теоретический расчёт «Примера 1» нашёл своё серьёзное подтверждение в экспериментах, выполненных на сердцах крыс[32], где изучался характер изменения уровня поляризации мембран кардиомиоцитов от содержания внеклеточного К+. Опыты показали, что увеличение внешнего клетке К+ действительно вызывает деполяризацию сарколеммы (таблица 11)
Таблица 11. Уровень поляризации мембран кардиомиоцитов в зависимости от трансмембранного градиента ионов К+
|
Содержание ионов К+ вне клетки в мМ×л-1 |
Уровень поляризации мембран кардиомиоцитов в мВ |
|
5 |
-80,0 ± 5,60 |
|
10 |
-70,6 ± 0,68 |
|
15 |
-66,2 ± 0,97 |
|
20 |
-56,0 ± 1,02 |
|
25 |
-36,7 ± 2,05 |
|
30 |
-40,3 ± 0,34 |
|
40 |
-35,2 ± 0,97 |
|
50 |
-35,3 ± 0,68 |
|
60 |
-34,3 ± 1,02 |
|
70 |
-35,2 ± 0,68 |
Увеличение К+ выше 25 мМ×л-1 нарушает эту закономерность и уровень поляризации мембран фактически не изменяется. Тогда это позволило сделать нам вывод, что трансмембранный потенциал так важен для жизнедеятельности кардиомиоцитов, что клетки сами стремятся удержать его на некоем «критическом» уровне. При этом не изменялось и содержание общетканевого[33], и внутриклеточного[34] К+.
В то время представлялось важным ответить на вопрос: расходуют ли кардиомиоциты энергию на удержание трансмембранного потенциала или нет?
Пользуясь расчётами Э. Лайтфута, собственными расчётами и данными, приведёнными в таблице, был построен график зависимости энергии DG, которое реально может поставить ионное фосфорилирование (о наличии которого мы стали тогда только подозревать), от содержания внеклеточного К+ (рисунок 19).
Результаты оказались поразительными: клетки действительно «борются» за свой потенциал. Его критический уровень равен -31 мВ. При таком уровне поляризации мембран, ионное фосфорилирование еще способно обеспечить энергией активный транспорт К+ и Nа+, но не меньше (по абсолютному значению). Большая деполяризация вынуждает систему компенсировать недостаток АТФ из его основного пула.
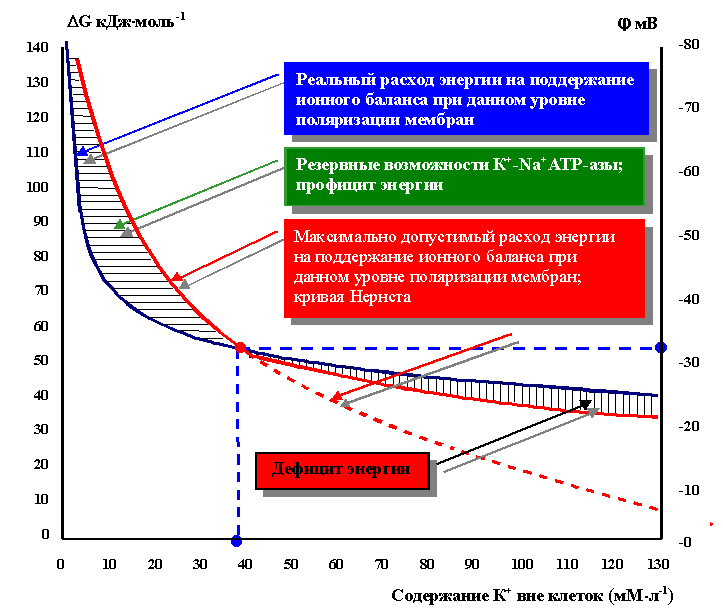
Рисунок 19. Энергетические возможности К+-Na+-АТР-азы, экспериментальные данные
Пример 3: Расчёт энергобаланса работы Na-Са-ионообменного механизма. По данным литературы[35] Na-Са-ионообменный механизм обладает следующими свойствами:
1. около 80% потока кальция из клетки и в клетку зависит от присутствия внешнего Na+ и Са++;
2. стехиометрия его работы такова, что 2 иона Na+ и 1 ион Са++ конкурируют между собой за один связывающий центр белка-переносчика сразу с обеих сторон мембраны;
3. соотношение Na+ : Са++ не является постоянным и зависит от концентрации этих ионов по обе стороны мембраны;
4. направленность работы Na-Са-обмена зависит от уровня поляризации мембраны;
5. критический уровень поляризации находится в пределах –30-40 мВ;
6. выходящий ток Са++ и работа Na-Са-обмена являются процессами энергозависимым, расходующими в состоянии покоя 1 моль АТР на транспорт 1 моля Са++ и 2 молей Na+;
7. существует мнение, что Na-Са–обмен, также как и Na-К–обмен, обеспечивается энергией отдельного пула АТР, поставляемой либо за счёт гликолитических процессов ([36]), либо за счёт энергии, освобождающейся при движении ионов по градиенту концентраций ([37]);
Для расчёта энергобаланса в процессе Na-Са-обмена ориентировались также на:
1. Содержание внутриклеточного Са++ = 10-8 моля
2. Содержание внеклеточного Са++ = 5×10-3 моля
3. Содержание внутриклеточного Na+ = 10-12×10-3 моля
4. Содержание внеклеточного Na+ = 110-120×10-3 моля
Таким образом:
1. Энергетические затраты: на транспорт массы 1 моля Са составляют 42,8 кДж DG;
2. Поставка энергии входящим током 2 молей неионизированного Na составляет 24,8 кДж DG
Итого: баланс отрицательный, равный –18,0 кДж DG, т.е.
для удаления из клетки 1 моля Са и 2 молей Na необходимо 42,8 кДж,
а тратится 18,0 кДж
или 0,55 молей АТР
для удаления из клетки 2 молей Са и 4 молей Na необходимо 85,6 кДж,
а тратится 36,0 кДж
или 1,10 молей АТР
для удаления из клетки 3 молей Са и 6 молей Na необходимо 128,4 кДж
а тратится 54,0 кДж
или 1,65 молей АТР
Пример 4: Расчёт энергетических возможностей Na-Са-обмена при изменении градиента Na+. Расчёты выполнены по аналогии с «Примером 2» и на основании экспериментальных данных с той лишь разницей, что оценивался не уровень поляризации мембран кардиомиоцитов, а их сократительная способность[38]. Теоретически, содержание ионов Na+ во внеклеточной среде должно находиться в прямо пропорциональной зависимости от количества энергии, выделяемой при движении Na+ через мембрану. Однако, это оказалось не так: энергия «поставляемая» трансмембранной диффузией ионизированного Na+. убывает много быстрее, чем неионизированного Na (рисунок 20). А это оказывает очень серьёзное влияние на энергобаланс Na-Са-обмена (рисунок 21), способного обеспечить энергией только малый градиент Са при нормальном распределении Na вне и внутри клетки.
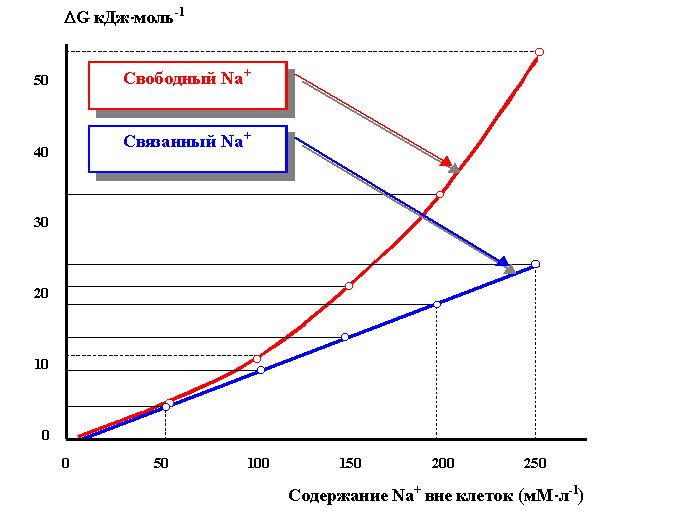
Рисунок 20. Зависимость образования энергии диффузными токами связанного (Na) и свободного (Na+) натрия от его [Na+] трансмембранного градиента; экспериментальные данные
В этой связи и на основании вышеизложенного, к энергии трансмембранного ионного транспорта можно и должно относиться как к одному из серьёзных источников энергии в органоидах и клетках, способной:
1. выступать донатором энергии для фосфорилирования АDР до АТР;
2. частично (до ~80%) компенсировать расходную часть энергозатрат на поддержание оптимальных трансмембранных ионных отношений в общем механизме ионного регулирования норм реакций и, соответственно, поддержания трансмембранного потенциала, как донатора энергии;
3. принимать самое живое участие в процессах регуляции водного баланса и осмотического давления;
4. непосредственно быть использованной в процессах терморегуляции;
5. быть применимой в качестве энергии активации для ряда катализаторов и каталитических систем.
Протонное фосфорилирование
Основным ионом, исполняющим роль инструментального обеспечения в механизмах синтеза АТР безусловно является ион водорода Н+ или протон, согласно подтверждённой временем хемоосмотической гипотезы, предложенной ещё в 1961 году английским биохимиком доктором Питером Митчеллом.
В результате активного окисления трикарбоновых кислот в цикле Кребса, в межмембранном пространстве митохондрий происходит активное накопление протонов Н+. При этом возникают два серьёзных градиента его концентрации:
1. между матриксом и межмембранным пространством внутри митохондрий и
2. между цитоплазмой и митохондриями.
Именно благодаря им (градиентам концентраций), возникают трансмембранный ток протонов Н+, энергетику которого легко рассчитать (рисунок 21).
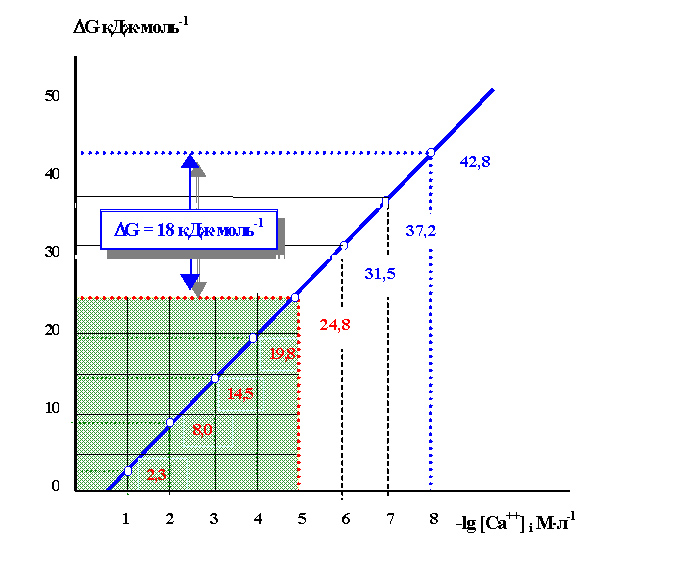
Рисунок 21. Энергобаланс системы Na-Са-обмена: на оси ординат энергетическая потребность Na-Са-обмена; на оси абсцисс – отрицательный логарифм содержания Са++ в клетке; АВ – количество энергии, необходимое для удаления из клетки 1 моля Са++ при данной концентрации Са++ внутри клетки; расстояние от любой точки на линии АВ до линии ВС характеризует количество энергии, необходимое для полного удаления Са++ (до 10-8М) при данном содержании Са++ вне клетки; заштрихованная зона – доля энергии, поставляемой током ионизированного Na+ при нормальном Na-градиенте.
Вместе с тем, вышеназванные градиенты протонов Н+ обеспечивают один из ключевых механизмов в процессах сопряжения:
1. дегидрогенизации трикарбоновых кислот с восстановле-нием FAD до FADH и NAD до NADH;
2. окисления FADH до FAD и NADH до NAD и восстановле-нием участников электрон-транспортной цепи;
3. окислением участников электрон-транспортной цепи и вос-становлением кислорода до воды;
4. транспорта электронов и фосфорилированием АDР до АТР;
5. дыхания с фосфорилированием (рисунок 22).
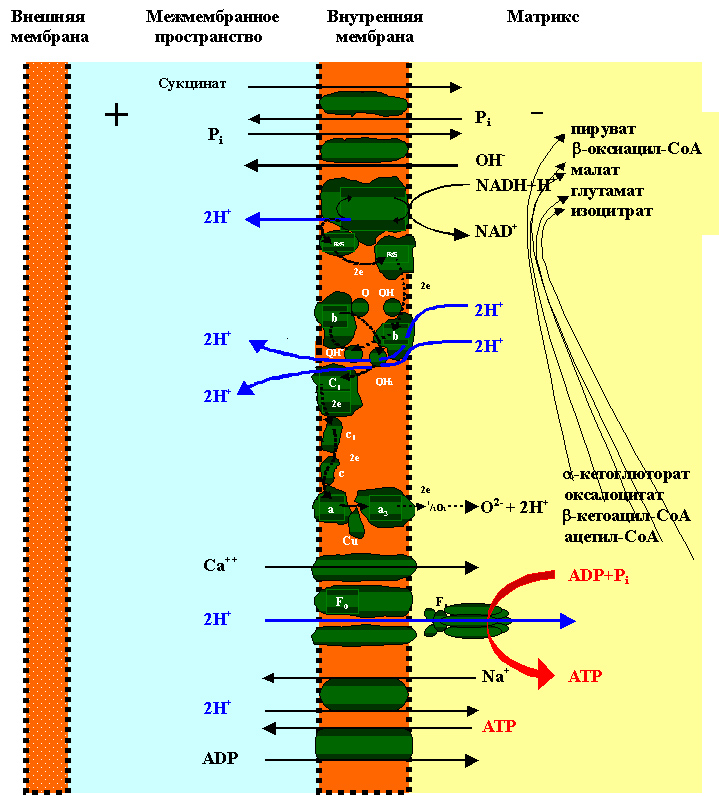
Рисунок 22. Хемоосмотический механизм образования АТР в митохондриях
Является ли протонный градиент лишь разновидностью механизмов ионного фосфорилирования или нет, это вопрос, безусловно, не имеющий сегодня чёткого и однозначного ответа. Этим ещё предстоит много и серьёзно заниматься.
Очевидно, истина, как ей обычно «водится», лежит где-то посредине, и её уточнение – дело будущих исследований. Ведь скорость движения ионов при их диффузии, безусловно, подчинена не только величине заряда иона, но его размеру и массе, а также диффузному расстоянию[39]. А от скорости движения заряженной частицы в электромагнитном поле зависит скорость производства энергии.
Вместе с тем, это, отнюдь, не исключает, а скорее наоборот, больше указывает на возможность не только потери ими ряда свойств и способностей, присущих лёгким ионам (протонам), но и на одновременное приобретение особенностей более тяжёлых.
Во всяком же случае, разница масс и скоростей ионных токов должна характеризоваться разной частотой рождаемых ими волновых характеристик, а это при детальном анализе исследовательских возможностей, может стать очень важным.
Сегодня же, с полной уверенностью можно утверждать лишь то, что градиент протонных концентраций в митохондриях являет собой основной генератор доступной формы энергии для синтеза АТР, заключаемой в её макроэргические связи, адаптированные для обеспечения большинства метаболических превращений эндо- и экзотермического свойства.
Вместо заключения
Таким образом, рассмотрев инструментальный запас исполнения и регулирования норм метаболических реакций на уровне глубоко специализированных гомеостатических устройств: органоидов и органелл, мы вплотную приблизились к тому, чтобы попытаться в разрастающемся многообразии их комбинаций и усложнений функций не потерять нить неспецифического и общего, начинающегося с:
1. фактора возмущения или «стресс-фактора», вызывающего
2. активацию неких акцепторных механизмов (акцепт информации), всегда сопровождающуюся
3. модуляцией поступающей информации до состояния её дееспособности, т.е. акцепта или, иначе, - деспециализации, которая так или иначе найдёт своё выражение в
4. нарушении клеточного гомеостаза (увеличение энтропии, изменение состава внутренней среды клетки), и завершится
5. физиологическим ответом, как обязательным компонентом обратной связи и как первый признак
6. эффекта адаптации, связанного с восстановлением клеточного гомеостаза, как высокоорганизованного исполнительного представителя метаболической нормы реакции, всегда стремящейся завершиться энергетически выгодным (эффективным)
7. состоянием покоя.
Глава 4
Гомеостаз клетки
[1] От греческого organon – орган и eidos - вид
[2] Термины «органоиды» и «органеллы» часто используют как синонимы, хотя в хрестоматийной биологии и классической цитологии органоидами принято называть внутриклеточные образования, имеющие мембранный тип строения, внутриклеточные же образования немембранного типа – это органеллы.
[3] может отсутствовать у половых клеток
[4] у животных клеток этот тип связи обеспечивается так называемыми высоко контактными мембранами
[5] от «не целевых» колебаний внешней среды
[6] Факт этой чувствительности неоспорим, ибо подтверждён громадным количеством эмпирических исследований и специальных наблюдений. Вот некоторые из них: Агулова Л.П. Принципы адаптации биологических систем к космогеофизическим факторам/Биофизика, 1998, том 43, вып. 4, с.571-574); Доронин В.Н., Парфентьев В.А., Тлеулин С.Ж., Намвар Р.А., Сомсиков В.М., Дробжев В.И., Чемерис А.В. Влияние вариаций геомагнитного поля и солнечной активности на физиологические показатели человека./В журн. Биофизика, 1998, том 43, вып. 4, с.647-653; Корнелиссен Ж., Халберг Ф., Бреус Т.К., Ватанабе И., Сотерн Р.Б., Хаус Е., Клейтмен Е., Вендт Х.В., Бинхам К. О проблеме происхождения биологической недели по данным о вариациях ритма частоты сердечных сокращений у людей в цикле солнечной активности/В журн. Биофизика, 1998, том 43, вып. 4, с.666-669; Мак-Фадден Б.Дж., Джонсон Д.С., Манн С., Нессон М.Х., Ловенстам Х.А., Прести Д.Е., Пэрри Э., Бауэр Г., Дайзон Э. И многие другие в книге Биогенный магнетит и магниторецепция. М.: Мир, 1989; Швецов Ю.П., Новиков В.В., Фесенко Е.Е., Чернов А.П., Иванов В.А. Молекулярные механизмы биологического действия слабых магнитных полей/В журн. Биофизика, 1998, ноябрь-декабрь, том 43, номер 6, с.977-980; Карнаухов А.В. Диссипативный резонанс и его роль в механизмах действия э/м излучения на биологические и физико-химические системы/В журн. Биофизика, 1997, том 42, вып 4, с.971-978 и т.д.
[7] Раздел составлен по материалам Волькинштейн М.В. Биофизика, М, Наука, 1988, 591 с; Мецлер Д. Биохимия, М, Мир, 1980, том 3, 488 с; Владимиров Ю.А., Рощупкин Д.И., Потапенко А.Я., Деев А.И Биофизика, М, Медицина, 1983, 271 с.; Либберт Э. Основы общей биологии, М, Мир, 1982, 437 с; Ленинджер А. Основы биохимии, М, Мир, 1985, там 2, с.683-716; Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика, М, Мир, 1991, 543 с; Клейтон Р. Фотосинтез, М, 1984; Фотосинтез, БЭС, Биология, М, Большая Российская энциклопедия, 1998, с.680-681.
[8] Gregory R.P.F. Biochemistry of Photosynthesis, Wiley, N.Y., 1971
[9] коррелирующих с принципом заполнения молекулярных орбиталей и главным квантовым числом
[10] в соответствии с принципом Паули (способность орбитали удерживать электроны является ограниченной, только один электрон может занимать данную спиновую орбиталь, два электрона могут занимать данную орбиталь только в том случае, если их спины противоположны); правилом Гунда (при прочих равных условиях состояние, в котором максимальное число электронов имеет параллельные спины, обладает наименьшей энергией); приближением Малликена или Вольберга-Гельмгольца (общая величина заряда в облаке перекрывания равна резонансному интегралу bАВ=CSAB(IA+IB); приближением Борна-Оппенгеймера (энергия молекулы зависит только от положения ядер, но не скоростей их движения, поэтому движения электронов и ядер могут рассматриваться отдельно)
[11] аналог «электронной дыры» в электронике
[12] правило Н.А. Онищенко
[13] часто процесс ускоренной диссоциации воды в процессе фотосинтеза называют «фотоокислением воды»
[14] Раздел составлен по материалам Волькинштейн М.В. Биофизика, М, Наука, 1988, 591 с; Мецлер Д. Биохимия, М, Мир, 1980, том 3, 488 с; Владимиров Ю.А., Рощупкин Д.И., Потапенко А.Я., Деев А.И Биофизика, М, Медицина, 1983, 271 с; Martin E.A Большой токовый медицинский словарь, Вече, Аст, М, 1999, с.270-271.
[15] по абсолютному порогу чувствительности зрения человека 2,1-5,7×10-17 Дж на поверхность роговицы глаза
[16] мы вынуждены принести свои извинения за то, что несколько нарушили последовательность изложения и начали говорить о фоторецепции зрения, происходящее в клетках сетчатки глаза, а не в специализированных органоидах, как это было в случае с хлоропластами. Но это видится простительным, коль скоро даёт своевременную возможность произвести определённые обобщения на ярких примерах фотосинтеза и фоторецепции
[17] энергия активации цис-транс-изомеризации ретиналей около 105 кДж×моль-1 ± 4 -12 кДж×моль-1
[18] то же следует сказать и о мембранах митохондрий. Это также послужило поводом для нас включить механизмы фоторецепции зрительных клеток в раздел, посвященный органоидам.
[19] Владимиров Ю.А., Рощупкин Д.И., Потапенко А.Я., Деев А.И Биофизика, М, Медицина, 1983, 271 с
[20] Меерсон Ф.З., Брегер А.М. Сопряжение возбуждения с сокращением и расслаблением сердечной мышцы. Ижевск: 1976, 91 с.; Kokuban Sh., Nishimura M., Noma A., Irisawa H. Membrane currents in the rabbit atrioventricular node cell./In: Pflugers Arch., 1982, 393, N 1, p.15-22; Mc Donald T.F., Электромеханическое сопряжение. Связь медленного входящего тока с сокращением./В кн.: Физиология и патофизиология сердца. М.: Медицина, 1988, т.1, с.278-295
[21] Keely S.L., Corbin J.D. Involvemen of cAMP-dependent protein kinase in the regulation of heart contractile force./In: Amer. J. Physiology, 1977, 233, N 2, H269-H275; Бреслер В.М., Никифоров А.А. Транспорт органических кислот через плазматические мембраны. Л.: Наука, 1981, 202 с.
[22] Вследствие низкой освещённости
[23] Волькинштейн М.В. Биофизика, М, Наука, 1988, 591 с.
[24] Martin E.A. Большой толковый медицинский словарь, Вече, Аст, М, 1999, том 2, с.270-271
[25] Волькинштейн М.В. Биофизика, М, Наука, 1988, 591 с.
[26] Servo-mechanism в переводе с английского языка – следящая система; в технике - сервомеханизм
[27] Правильнее было бы записать: К-Na; Na-Са-ионообменный транспорт, не выставляя аббревиатуру (+) или (-), хотя, наверное, это и не так принципиально, коль широко используется в специализированной литературе
[28] Давид Р. Введение в биофизику. М.: Мир, 1982, 205 с.
[29] Кошкин Н.И., Ширкевич М.Г. Справочник по элементарной физике. М.: Наука, 1982, 96 с.
[30] Мецлер Д. Биохимия. М. Мир, 1980г., 606 с.
[31] Лайтфут Э. Явления переноса в живых системах. М.: Мир, 1977, 518 с.
[32] Лубяко А.А., Бодров С.С. Оптимизация ионных концентраций изоосмолярных кардиоплегических растворов на полоске миокарда./В кн.: Актуальные проблемы трансплантологии и искусственных органов. М.: 1980, 107-110; Лубяко А.А., Кирпатовский В.И., Онищенко Н.А. Механизм защиты и повреждения миокарда при действии кардиоплегических растворов./В журн.: Кардиология, 1983, 7, с.51-55; Лубяко А.А. К механизму работы трансмембранной системы натрий -кальциевого обмена./ В кн.: Трансплантация и искусственные органы. М.: 1984, с.108-110; Лубяко А.А. Противоишемическая защита миокарда кардиоплегическими растворами. Дис. ... канд.биол.наук. М. 1986г., 189 с.
[33] Лубяко А.А. Противоишемическая защита миокарда кардиоплегическими растворами. Дис. ... канд.биол.наук. М. 1986г., 189 с.
[34] Carmeliet E. Reduction of potassium permeability by chloride substitution in cardiac cells./In: Proc. Int. Union Physiology. Sci.//27-th Int. Congr.///Paris, 1977, 12, p.289; Carmeliet E., Verdouck F. Reduction of potassium permeability by chloride substitution in cardiac cells. /In: J. Physiology, Gr. Brit., 1977, 265, 1, p.193-206; Carmeliet E. Time dependent conductance change of the inward potassium rectifier (Ik) in sheep cardiac Purkinje fibers./In: J. Physiology // Gr. Brit., 1981, 320, P27;
[35] Меерсон Ф.З., Брегер А.М. Сопряжение возбуждения с сокращением и расслаблением сердечной мышцы. Ижевск: 1976, 91 с; Reuter H. Properties of the Two Inward Membrane Currents in the Heart. / In.: Amer. Rev. Physiology, 1979 y., 41, p.413-424; Kokuban Sh., Nishimura M., Noma A., Irisawa H. Membrane currents in the rabbit atrioventricular node cell./In: Pflugers Arch., 1982, 393, N 1, p.15-22; Langer G.A. Sodium-calcium exchange in the heart. / In.: Annu. Rev. Physiology, 1982, v.44, p.435-449; Chapman R.A., Coray A., Mc Guigan J.A. Sodium/calcium exchange in mammalian ventricular muscle. / In.: J. Physiology, 1981, 318, P13-P14; Dhalla N.S., Pierce G.N., Panagia V., Singal P.K., Beamish R.E. Calcium movements in relation to heart function./In: Basic Res. Cardiology, 1982, 77, N2, p.117-139
[36] Меерсон Ф.З. Патогенез и предупреждение стрессорных и ишемических повреждений сердца. М. Медицина, 1984 г., с.268.
[37] Меерсон Ф.З., Брегер А.М. Сопряжение возбуждения с сокращением и расслаблением сердечной мышцы. Ижевск: 1976, 91 с; Мецлер Д. Биохимия. М. Мир, 1980г., с.606.
[38] Лубяко А.А., Бодров С.С. Оптимизация ионных концентраций изоосмолярных кардиоплегических растворов на полоске миокарда./В кн.: Актуальные проблемы трансплантологии и искусственных органов. М.: 1980, 107-110; Лубяко А.А. Противоишемическая защита миокарда кардиоплегическими растворами. Дис. ... канд.биол.наук. М. 1986г., 189 с.